Al Tigem di Pozzuoli, Gennaro Napolitano studia in che modo alterazioni dei percorsi metabolici cellulari possano essere alla base di malattie genetiche rare. Con il sogno e la speranza di essere d’aiuto concreto ai pazienti.
Quando si parla di metabolismo molti pensano a quello generale dell’organismo e, magari, a modi più o meno validi per “riattivarlo” o “accelerarlo”, con l’obiettivo di dimagrire. Per chi si occupa di malattie genetiche rare, però, il metabolismo da studiare di solito è un altro: quello delle cellule, perché alcune di queste malattie sono causate da difetti di geni coinvolti proprio nel metabolismo cellulare. Esattamente ciò di cui si occupa Gennaro Napolitano, dal 2020 capogruppo di ricerca all’Istituto di Genetica e Medicina (Tigem) di Pozzuoli.
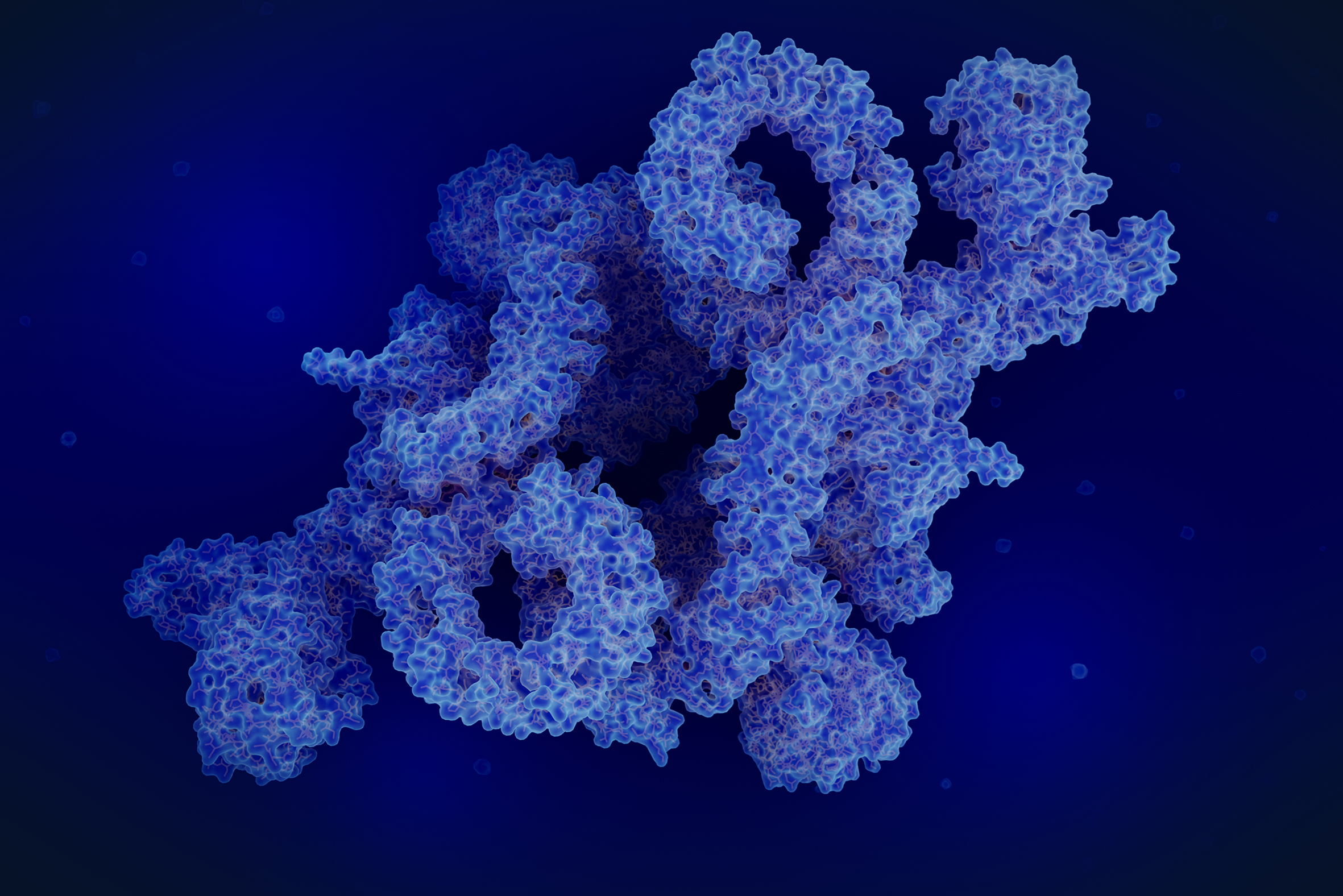
Napolitano è tra gli autori di uno studio che, di recente, ha descritto in dettaglio le modalità di interazione di due proteine-chiave per mantenere il corretto equilibrio tra le due fasi fondamentali del metabolismo cellulare: l’anabolismo, cioè la costruzione di molecole complesse a partire da “mattoncini” chimici di base, e il catabolismo, la degradazione di molecole complesse in “mattoncini” più piccoli. Le due proteine si chiamano mTOR e TFEB e conoscere meglio il modo in cui interagiscono è un primo passo fondamentale per lo studio di nuove terapie per diverse patologie, tra le quali due malattie genetiche rare caratterizzate da un elevato rischio di sviluppare tumori: la sclerosi tuberosa e la sindrome di Birt-Hogg-Dubé (BHD). «È quello per cui lavoro ogni giorno» conferma il ricercatore. «Produrre risultati che possano servire ai pazienti delle malattie che studio. La mia è ricerca di base, ma è da qui che bisogna partire per sperare di arrivare, un giorno, a nuove terapie».
Dall’Italia all’America
Punto di partenza di Napolitano, invece, è stata la laurea in scienze biologiche all’Università Federico II di Napoli, seguita da un dottorato di ricerca in biologia avanzata conseguito all’Istituto di genetica e biofisica del CNR. Poi l’avventura americana, all’Università della California di San Diego e allo Scripps Research Institute di La Jolla, sempre in California: un iter naturale per un giovane che sognava da sempre di fare il ricercatore.
«Durante il dottorato avevo cominciato a occuparmi di quello che in gergo chiamiamo signaling, cioè l’insieme dei meccanismi che permettono alla cellula di percepire quello che c’è nell’ambiente esterno e di modulare di conseguenza il proprio comportamento» spiega Napolitano. Proprio quello che, su scala differente, facciamo noi esseri umani: attraverso i sensi ci rendiamo conto di quello che succede intorno a noi e agiamo di conseguenza. «In particolare - prosegue - mi occupavo di come le cellule reagiscono alla presenza di virus e batteri montando una risposta infiammatoria. C’è però un altro ambito fondamentale del signaling, cioè quello del metabolismo, che permette alle cellule di modulare il proprio comportamento metabolico sulla base della disponibilità o meno di nutrienti. Se nei dintorni della cellula c’è abbondanza di nutrienti, la cellula sa che può crescere e moltiplicarsi. Viceversa, se i nutrienti scarseggiano sa che deve adattare il suo metabolismo a quelle condizioni, bloccando una serie di attività e cercando di reperire nutrienti attingendo a fonti interne».
Una volta arrivato negli Stati Uniti, Napolitano ha cominciato a occuparsi anche di lisosomi, organelli cellulari che sono sempre descritti come gli inceneritori della cellula, perché svolgono la degradazione delle sostanze di rifiuto prodotte continuamente dal metabolismo cellulare. «È cominciato così anche il mio interesse per le malattie da accumulo lisosomiale e in particolare per la cistinosi, una malattia metabolica rara causata da un difetto metabolico che comporta l’accumulo nel lisosoma di un amminoacido. Da un lato la cellula non ha più a disposizione una sufficiente quantità di quell’amminoacido per costruire nuove molecole e, dall’altro, il lisosoma non riesce più a funzionare in modo corretto».
Di lisosomi, proteine e metabolismo (ma la complessità non ci spaventa!)
Come è successo per i mitocondri, anche i lisosomi sono oggetto di una riscoperta. «Ora sappiamo che sono anche un fondamentale centro di controllo del metabolismo cellulare, perché sono in grado di raccogliere informazioni sulla disponibilità di nutrienti e di guidare una possibile risposta metabolica». È per questo che hanno una stretta relazione sia con il signaling relativo al metabolismo sia con le proteine mTOR e TFEB.
È l’equilibrio costante dell’attività di queste due proteine a far sì che, in condizioni normali, il metabolismo cellulare sia sintonizzato sulle condizioni ambientali circostanti. «Quando i nutrienti sono sufficienti, questo equilibrio permette alla cellula di utilizzarli come “mattoncini” che le servono per costruire nuove molecole necessarie alle sue varie attività. Quando invece scarseggiano, la relazione tra mTOR e TFEB cambia, mettendo in moto la degradazione delle sostanze di riserva accumulate» spiega Napolitano. Ed è qui che entrano in gioco i lisosomi, perché è proprio su questi organelli che si incontrano fisicamente mTOR e TFEB, dando il via alla regolazione del metabolismo sulla base delle informazioni raccolte dai lisosomi stessi sullo stato dei nutrienti.
Se vi sembra un rompicapo non preoccupatevi: lo è. «Ogni volta che si riesce a capire qualcosa di molto complesso, dietro l’angolo troviamo subito qualcosa di altrettanto complesso da decifrare» conferma il ricercatore. «Può sembrare un limite di questo lavoro, e invece è la parte più affascinante ed entusiasmante».
Ritorno a Pozzuoli
Negli Stati Uniti Napolitano è rimasto cinque anni: là si è sposato con la collega Jlenia Monfregola e là nel 2012 è nato il loro figlio Andrea. «A un certo punto abbiamo sentito il desiderio di tornare in Europa e abbiamo cominciato a guardarci intorno. La scelta è caduta sul Tigem, non perché è a Napoli ma perché è uno degli Istituti più importanti al mondo per la ricerca sulle malattie da accumulo lisosomiale. Spesso, infatti, ai congressi sentivo parlare dei risultati ottenuti proprio da questo Istituto su argomenti simili a quelli che studiavo io».
La coppia è quindi tornata in Italia, per lavorare inizialmente nel laboratorio del direttore del Tigem, Andrea Ballabio, scopritore nel 2009 proprio della proteina TFEB. «Anche se eravamo nello stesso laboratorio, in realtà non lavoravamo sugli stessi progetti, oppure lo facevamo da punti di vista diversi, perché abbiamo competenze diverse. Meglio tenere separate la vita professionale e quella lavorativa» scherza il ricercatore.
Entrambi, comunque, sono tra gli autori principali, insieme proprio a Ballabio, dell’articolo che descrive nei minimi dettagli l’interazione tra mTOR e TFEB: una fotografia ad altissima risoluzione scattata anche grazie alla collaborazione con un gruppo di ricerca americano dotato di un super microscopio. «Grazie a questo risultato, ora possiamo visualizzare tutti i possibili bersagli farmacologici a nostra disposizione per intervenire nel caso in cui venga meno l’equilibrio tra le due proteine». Proprio quello che accade nella sclerosi tuberosa e nella sindrome di Birt-Hogg-Dubé (BHD), ma anche in vari tipi di tumore come quello al rene, il melanoma o il tumore al pancreas. «E non è un caso - sottolinea Napolitano - perché anomalie del metabolismo sono uno dei tratti caratteristici delle cellule tumorali». A dimostrazione, ancora una volta, di quanto i risultati della ricerca su meccanismi di base coinvolti nell’insorgenza di malattie rare possa avere ricadute di grande valore anche per malattie più comuni.